اکسیژن (Oxygen)، که فراوانترین عنصر در پوسته زمین و سومین عنصر فراوان در کیهان است، نقشی بنیادی در تعریف حیات بر روی سیاره ما ایفا میکند. در بافتهای بیولوژیکی، اکسیژن مولکولی () یک دیرادیکال دو الکترونی با دو الکترون جفتنشده است، که از لحاظ ترمودینامیکی آن را به یک عامل اکسنده قوی تبدیل میکند. برای دههها، درک ما از این مولکول محدود به نقش آن در تنفس سلولی بود؛ فرآیندی که انرژی لازم برای بقا و عملکرد سلولها را تأمین میکند. با این حال، دانش زیستشیمی مدرن نشان میدهد که اکسیژن فراتر از یک مصرفکننده نهایی در زنجیره تولید انرژی عمل میکند؛ این مولکول یک عامل تنظیمی حیاتی، یک بستر بیوسنتزی، و یک واسطه فعال در مسیرهای سیگنالدهی سلولی است. در واقع، متابولیسم سلولی یک گفتگوی مداوم و دقیق بین نیاز به انرژی و مدیریت پتانسیل اکسیداسیون است که اکسیژن در مرکز آن قرار دارد. این مقاله به تشریح این نقشهای چندوجهی اکسیژن میپردازد و نشان میدهد که چگونه این مولکول به طور همزمان هم حافظ بقا و هم منشأ آسیبهای سلولی است.
عملکرد محوری: اکسیژن در میتوکندری و تولید انرژی
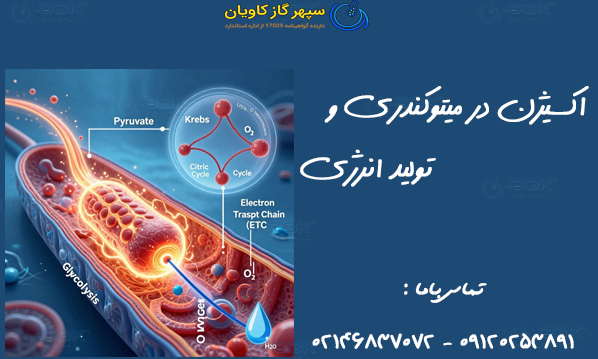
مهمترین و شناختهشدهترین نقش اکسیژن در سلولهای یوکاریوتی، جایگاه آن به عنوان پذیرنده نهایی الکترون (Terminal Electron Acceptor) در زنجیره انتقال الکترون (ETC) واقع در غشای داخلی میتوکندری است. این فرآیند که به عنوان فسفریلاسیون اکسیداتیو شناخته میشود، کارآمدترین روش برای استخراج انرژی از مواد مغذی است.
مسیرهای تجزیه کربوهیدراتها (گلیکولیز) و لیپیدها، الکترونهایی پرانرژی را از طریق حاملهایی مانند و به کمپلکسهای پروتئینی ETC هدایت میکنند. این الکترونها در طول زنجیره از کمپلکس I تا IV حرکت میکنند و در هر مرحله انرژی آزاد میکنند که صرف پمپ کردن پروتونها () به فضای بین غشایی میشود و پتانسیل الکتروشیمیایی لازم برای سنتز توسط آنزیم سنتاز را فراهم میآورد.
سرانجام، این الکترونها به انتهای زنجیره میرسند. بدون حضور اکسیژن، ETC متوقف شده و فرآیند تولید انرژی در سطح سلولی عملاً متوقف میگردد. اکسیژن با جذب چهار الکترون و چهار یون هیدروژن، به مولکول پایدار آب تبدیل میشود:
این واکنش نه تنها الکترونها را از مسیر خارج میکند و اجازه میدهد که جریان الکترون و تولید ادامه یابد، بلکه یکی از محصولات جانبی غیرسمی و ضروری (آب) را نیز تولید میکند. این کارایی بالا (تولید حدود 30 تا 34 مولکول در هر مولکول گلوکز) است که به ارگانیسمهای هوازی اجازه میدهد انرژی بسیار بیشتری نسبت به تخمیر یا تنفس بیهوازی کسب کنند و در نتیجه پیچیدگیهای ساختاری و متابولیکی بالاتری داشته باشند.
فراتر از انرژی: اکسیژن به عنوان بستر بیوسنتزی
گرچه تولید انرژی غالب است، اما اکسیژن در ساخت بسیاری از مولکولهای ضروری برای ساختار و عملکرد سلولی نیز دخیل است. در این مسیرها، اکسیژن نه تنها به عنوان یک اکسنده، بلکه به عنوان یک جزء ساختاری یا فعالکننده آنزیمی عمل میکند.
فعالسازی آنزیمی و هیدروکسیلاسیون
بسیاری از آنزیمها برای انجام وظایف خود نیاز به واکنشهایی دارند که شامل وارد کردن یک گروه هیدروکسیل () به یک سوبسترا (واکنش هیدروکسیلاسیون) هستند. این فرآیند اغلب توسط آنزیمهایی کاتالیز میشود که از اکسیژن مولکولی به عنوان یک واکنشدهنده کلیدی استفاده میکنند. برجستهترین نمونه، خانواده آنزیمهای سیتوکروم P450 است که در کبد متمرکز بوده و نقش حیاتی در سمزدایی داروها و متابولیسم استروئیدها ایفا میکنند. این آنزیمها را به گونههای بسیار واکنشپذیر تبدیل کرده تا بتوانند مولکولهای آبگریز را هیدروکسیله کنند، عملی که حلالیت آنها را افزایش داده و دفع از بدن را تسهیل میبخشد.
ساختاردهی بافتهای همبند
در حوزه بیوشیمی ساختاری، اکسیژن برای تثبیت ماتریکس خارج سلولی ضروری است. برای مثال، در سنتز کلاژن—پروتئین اصلی بافت همبند—آنزیمهایی مانند پرولیل هیدروکسیلاز و لیزیل هیدروکسیلاز نیازمند اکسیژن هستند. این آنزیمها گروههای هیدروکسیل را به اسیدهای آمینه پرولین و لیزین موجود در زنجیرههای پلیپپتیدی کلاژن اضافه میکنند. این گروههای هیدروکسیل برای ایجاد پیوندهای هیدروژنی پایدار که ساختار سهگانه مارپیچ (Triple Helix) کلاژن را تثبیت میکنند، حیاتی هستند. بدون اکسیژن کافی، این تثبیت رخ نمیدهد، که نتیجه آن سستی بافتها و بروز بیماریهایی مانند اسکوربوت (کمبود ویتامین C که کوفاکتور این هیدروکسیلازها است) خواهد بود.
حسگر محیطی: اکسیژن و تنظیم رونویسی ژن
در محیطهای چند سلولی، جایی که دسترسی به اکسیژن در سراسر بدن یکنواخت نیست (مثلاً در تومورها، زخمهای در حال التیام، یا اعماق بافتها)، سلولها باید مکانیسمهایی برای تشخیص و پاسخ به تغییرات فشار جزئی اکسیژن () داشته باشند. در این زمینه، اکسیژن به عنوان یک سیگنال محیطی عمل کرده و مسیرهای ژنتیکی را کنترل میکند.
محور اصلی این تنظیم، فاکتور القا شده توسط هیپوکسی (Hypoxia-Inducible Factor یا HIF) است. یک پروتئین دایمر است که از دو زیرواحد تشکیل شده است: (زیرواحد حساس به اکسیژن) و (زیرواحد پایدار).
در شرایط عادی (نرموکسی):
زیرواحد در سیتوپلاسم قرار دارد و توسط آنزیمهای ویژهای که حاوی آهن هستند و به اکسیژن وابسته میباشند، مورد حمله قرار میگیرد. این آنزیمها (پروپروتیین هیدروکسیلازها) یک باقیمانده پرولین را در هیدروکسیله میکنند. این تغییر شیمیایی به عنوان یک برچسب عمل کرده و باعث شناسایی توسط کمپلکس و متعاقباً تخریب سریع آن توسط سیستم یوبیکوئیتین-پروتئازوم میشود.
در شرایط کمبود اکسیژن (هیپوکسی):
فعالیت آنزیمهای هیدروکسیلاز به دلیل کمبود سوبسترا (اکسیژن) کاهش مییابد. در نتیجه، دیگر هیدروکسیله نمیشود، از تخریب نجات یافته، در سیتوپلاسم تجمع مییابد و سپس به هسته سلول منتقل میشود. در هسته، با زیرواحد ترکیب شده و به مناطق پروموتر ژنهای پاسخدهنده به هیپوکسی متصل میشود. این اتصال، رونویسی ژنهایی را که بقای سلول را در محیط کماکسیژن تضمین میکنند، فعال میسازد. این ژنها شامل:
- عوامل رگزایی (مانند VEGF): برای تحریک تشکیل رگهای خونی جدید و بهبود خونرسانی.
- آنزیمهای گلیکولیتیک: برای افزایش کارایی تولید از طریق مسیرهای بیهوازی.
- آنزیمهای مربوط به اریتروپوئزیس: برای افزایش ظرفیت حمل اکسیژن در خون.
این سیستم نشان میدهد که اکسیژن نه تنها در فرآیند نهایی تولید انرژی نقش دارد، بلکه فعالانه مسیرهای ژنتیکی را هدایت میکند تا سلول بتواند خود را با شرایط محیطی متغیر سازگار سازد.
جنبه دوگانه: اکسیژن به عنوان سیگنالدهنده و مهاجم (ROS)
شاید متناقضترین نقش اکسیژن، پتانسیل آن برای تولید گونههای فعال اکسیژن (Reactive Oxygen Species یا ) باشد. در حالی که به دلیل نقششان در آسیب سلولی بدنام هستند، در غلظتهای پایین و کنترلشده، این مولکولها واسطههای سیگنالدهی حیاتی به شمار میروند.
تولید کنترلشده ROS
در حین تنفس هوازی، حدود 1 تا 3 درصد از اکسیژنی که وارد زنجیره انتقال الکترون میشود، به جای کاهش کامل به آب، به طور ناقص احیا میشود. این احیای ناقص منجر به تولید رادیکال سوپراکسید () میشود:
این رادیکال سوپراکسید توسط آنزیم سوپراکسید دیسموتاز () به پراکسید هیدروژن () تبدیل میشود که نسبتاً پایدارتر است و میتواند از غشای میتوکندری عبور کند.
ROS به عنوان پیامرسان
در دوزهای پایین، به عنوان یک پیامرسان ثانویه عمل میکند. این مولکول میتواند پروتئینهای سیستئین موجود در مسیرهای پیامرسانی را به صورت برگشتپذیر اکسید کند و مسیرهایی مانند (مسیر پروتئین کیناز فعال شده توسط میتوژن) و (فاکتور هستهای کاپا بی) را تنظیم نماید. این مسیرها مستقیماً با تنظیم پاسخهای التهابی، تکثیر سلولی و بقای سلولی در ارتباط هستند. به عنوان مثال، تحریک خفیف اکسیداتیو ناشی از ورزش میتواند سیگنالهایی را آغاز کند که منجر به افزایش بیان آنزیمهای آنتیاکسیدان محافظتی میشود.
مرز باریک: استرس اکسیداتیو
مشکل زمانی آغاز میشود که تولید از ظرفیت سیستمهای آنتیاکسیدان سلول (مانند گلوتاتیون، کاتالاز و ) فراتر رود. این وضعیت استرس اکسیداتیو نامیده میشود. در این حالت، بیش از حد واکنشپذیر شده و به صورت غیرانتخابی به اجزای حیاتی سلول حمله میکنند:
- پراکسیداسیون لیپیدها: حمله به غشاهای سلولی و میتوکندری، تخریب یکپارچگی غشاء.
- آسیب پروتئینی: اکسیداسیون آمینواسیدهای حساس و تغییر شکل (دناتوره شدن) پروتئینها، که عملکرد آنها را مختل میکند.
- آسیب : تشکیل بازهای آسیبدیده مانند 8-هیدروکسی گوانین، که میتواند منجر به جهشهای ژنتیکی و در نهایت سرطان یا پیری زودرس شود.
بنابراین، اکسیژن یک شمشیر دو لبه است: در تعادل، برای سیگنالدهی ضروری است؛ در عدم تعادل، عامل اصلی آسیب و تخریب سلولی است.
اکسیژن در متابولیسم خاص: نقش در متابولیسم نورونها
تأکید بر نقش اکسیژن در بافتهایی با نیاز انرژی بالا مانند مغز، اهمیت این مولکول را دوچندان میکند. نورونها تقریباً به طور انحصاری به تنفس هوازی متکی هستند و کمتر از سایر سلولها توانایی استفاده از گلیکولیز بیهوازی را دارند. این وابستگی مطلق به میتوکندری و اکسیژن باعث میشود که سلولهای عصبی به ویژه در برابر کمبود اکسیژن (ایسکمی یا سکته مغزی) آسیبپذیر باشند.
در زمان ایسکمی، توقف ناگهانی تأمین منجر به فروپاشی سریع تولید و عدم توانایی در حفظ گرادیانهای یونی غشاء میشود. این امر به دپولاریزاسیون سلولی و فعال شدن شدید مسیرهای مرگ سلولی (آپوپتوز و نکروز) میانجامد. علاوه بر این، در مرحله پس از ایسکمی، هنگامی که جریان خون مجدداً برقرار میشود (Reperfusion)، یک موج ناگهانی اکسیژن وارد بافتهای آسیبدیده میشود و تولید تودهای از را در میتوکندریهای از کار افتاده تحریک میکند که خود عامل آسیب ثانویه گستردهای است.